4.2 Wie produzieren wir Enzyme für industrielle Anwendungen?
In diesem Video findet ihr die wichtigsten Grundlagen zu Enzymproduktion zusammengefasst. Die Hintergrundinformationen dazu findet ihr in diesem Kapitel.
Grundlagen
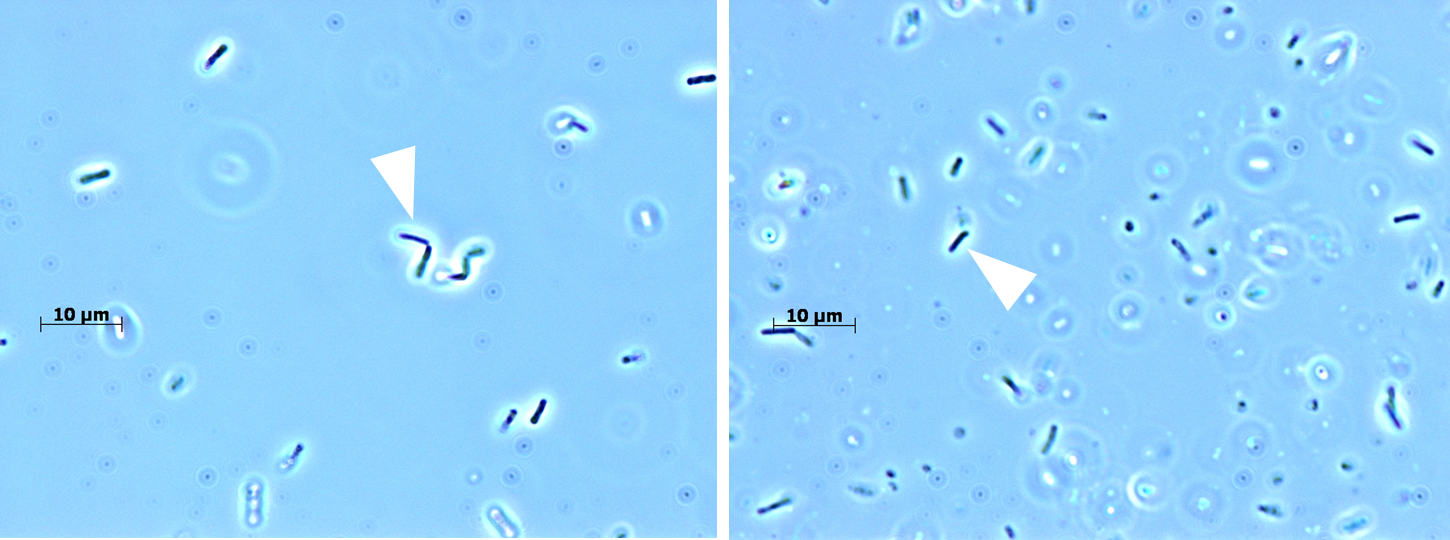
Für biotechnologische Anwendungen produzieren wir Enzyme meist nicht in den Organismen, in denen sie entdeckt wurden. Stattdessen verwenden wir speziell für die Produktion optimierte Organismen, die sogenannten Wirte. Dies können Bakterien, Pilze (z. B. Bäckerhefe) oder tierische und pflanzliche Zelllinien sein. Unter den Bakterien werden am häufigsten verschiedene Stämme von Escherichia coli und Bacillus verwendet.
Abb.: Mikroskopische Ansicht von *Bacillus* (links) und *E. coli* (rechts)
Die Produktionsstämme funktionieren wie kleine Zellfabriken. Mit dem richtigen „Bauplan“ für das Enzym können wir die Bakterien so beeinflussen, dass sie sehr viel von unserem gewünschten Enzym produzieren. Der Vorteil an diesem Verfahren ist, dass diese Wirte deutlich mehr von dem Enzym produzieren als der Originalwirt, aus dem das Enzym ursprünglich stammt.
Am einfachsten ist es, wenn wir unser Gen in einem ringförmigen DNA-Molekül, dem sogenannten Plasmid, in unser Produktionsbakterium einbringen. Das Plasmid ist dabei wie eine Speicherkarte und enthält neben dem Gen, was für unser Enzym kodiert, noch weitere regulatorische Einheiten. Eine davon ist der Promotor, der wie ein An- und Ausschalter das Ablesen der genetischen Information für die Produktion unseres Proteins steuert.
Der Promotor ist induzierbar, das heißt, er kann durch bestimmte Stoffe, sogenannte Induktoren, aktiviert werden. Unser Protein wird also nur dann produziert, wenn der passende Induktor vorhanden ist. Durch Hinzufügen von Induktoren können wir also die Herstellung unseres Proteins aktivieren.
Proteinproduktion mit E. coli
In E. coli sammelt sich während der Proteinherstellung sehr viel von unserem Enzym in der Zelle an. Im Regelfall werden die Proteine richtig gefaltet, wodurch sie aktiv und in löslicher Form in der Zelle vorkommen. Bei einigen Enzymen, die etwas mehr Zeit für ihre Faltung benötigen, kann dies Probleme bereiten. Durch die unvollständige Faltung bilden sich dann große Aggregate aus zusammengelagerten inaktiven Enzymen.
Nach der Produktion in E. coli können wir unser Protein dann ernten. Dafür trennen wir die Zellen, die unser Protein enthalten, aus dem Kulturmedium ab. Um das Protein freizusetzen, müssen die Zellen dann aufgebrochen, also kaputt gemacht werden.
Zellaufschluss mittels French Press
 Um Bakterienzellen aufzubrechen und an den Zellinhalt zu gelangen, gibt es verschiedene Methoden. Eine davon ist die sogenannte French Press. Dabei wird die Zellsuspension mit Hilfe eines Kolbens und Zylinders unter Druck gesetzt, wodurch das 85-fache des atmosphärischen Drucks erreicht wird! Die Zellen werden dann durch einen schmalen Auslass aus dem Zylinder herausgelassen. Durch den starken Druckabfall platzen die Zellen auf und der Zellinhalt wird freigesetzt.
Um Bakterienzellen aufzubrechen und an den Zellinhalt zu gelangen, gibt es verschiedene Methoden. Eine davon ist die sogenannte French Press. Dabei wird die Zellsuspension mit Hilfe eines Kolbens und Zylinders unter Druck gesetzt, wodurch das 85-fache des atmosphärischen Drucks erreicht wird! Die Zellen werden dann durch einen schmalen Auslass aus dem Zylinder herausgelassen. Durch den starken Druckabfall platzen die Zellen auf und der Zellinhalt wird freigesetzt.
Das Zelllysat, was beim Aufbrechen der E. coli-Zellen entsteht, enthält neben unserem Zielprotein auch noch viele weitere, die für den Stoffwechsel der Zellen unerlässlich sind. Man erhält also ein Gemisch aus vielen unterschiedlichen Proteinen. Dieses Gemisch kann man mittels SDS-PAGE sichtbar machen, wobei die verschiedenen Proteine in einem Polyacrylamid-Gel der Größe nach aufgetrennt werden.
Schaut euch in diesem Video, wie sich Proteine mittels SDS-Page analysieren lassen.
Wie werden Gele für die SDS-Page hergestellt? In diesem Video findet ihr es heraus:
Proteinproduktion mit Bacillus
Für die Produktion von Proteinen kann man auch Bacillus, ein anderes Bakterium, verwenden. Auch bei Bacillus werden die für die Produktion des Proteins benötigten Informationen auf einem Plasmid in die Zellen eingebracht. Die Proteinproduktion wird auch hier mittels eines Induktors gestartet.
Bacillus ist aber auch in der Lage, die in der Zelle produzierten Proteine in das umgebende Kulturmedium abzugeben. Dadurch bleibt die Konzentration an Zielprotein in der Zelle gering und die Bildung von inaktiven Enzymaggregaten ist weniger wahrscheinlich.
Wenn wir unser Protein nach der Produktion mit Bacillus ernten wollen, trennen wir die Zellen vom Kulturmedium ab. Unser Zielprotein befindet sich frei im Kulturmedium, weswegen wir keine Zellen aufschließen müssen. Im Optimalfall sind neben unserem Protein nur wenige andere Proteine im Medium. Allerdings ist unser Protein auch im Vergleich zur E. coli- Produktion viel verdünnter. Deshalb muss es konzentriert werden.
Je nachdem, um was für eine industrielle Anwendung es sich handelt, müssen die Zielenzyme rein oder weniger rein sein. In manchen Fällen können andere Proteine oder Stoffe aus den Zellen oder Nährmedien störend sein.
Dann müssen die Proteine gereinigt werden. Soll das Zielprotein konzentriert und kleinere Moleküle entfernt werden, so gibt es die Möglichkeit über Membranen, die wie eine Art Sieb funktionieren, kleinere Moleküle und Flüssigkeit abzutrennen. Das Zielprotein wird hierbei zurückgehalten.
GRAS-Organismen
GRAS steht für Generelly Regarded As Safe und bedeutet, dass der Organismus allgemein als nicht gesundheitsgefährdend gilt. Die Verwendung von GRAS-Organismen ist besonders in der Lebensmittelindustrie von Bedeutung. E. coli z.B. gilt im Allgemeinen nicht als GRAS-Organismus, da die meisten E. coli Stämme in der Lage sind Toxine zu produzieren. Vor einigen Jahren wurde viel über EHEC berichtet. Als EHEC (enterohämorrhagischer E. coli) werden E. coli Stämme bezeichnet, die beim Menschen für blutigen Durchfall sorgen können. Diese Pathogenität der Stämme ist auf Toxine zurückzuführen. Obwohl zur Enzymproduktion im Labor E. coli Stämme verwendet werden, die keine Toxine produzieren, besteht die nahe Verwandtschaft zu Toxinbildnern. Außerdem ist E. coli in der Öffentlichkeit als Darmbakterium bekannt und würde auf Lebensmittelpackungen sicher auf Ablehnung stoßen.
Anders ist es z.B. bei B. subtilis. Stämme dieser Art können keine Toxine bilden und sind allgemein als sicher anerkannt. Außerdem wird meistens bei einer Proteinproduktion das gewünschte Enzym aus dem Organismus hinausgeschleust und kann so in verschiedenen Prozessen direkt eingesetzt werden, ohne dass die Zellen zerstört werden müssen und Proteine und andere Zellbestandteile frei werden. Verschiedene Präparate, die mit rekombinanten B. subtilis Stämmen hergestellt wurden, kommen bereits in verschiedenen Industriezweigen, unter anderem auch in der Lebensmittelindustrie, zum Einsatz.
Reinigung von Proteinen
Für die Reinigung des Zielproteins aus Proteingemischen gibt es andere Methoden. Hitzestabile oder salztolerante Zielproteine, die aus Extremophilen stammten, können durch Hitze oder hohe Salzkonzentrationen gereinigt werden. Durch die extremen Bedingungen denaturieren die Proteine des nicht extremen Produktionsstammes. Sie werden dadurch unlöslich und können abgetrennt werden.
Säulenchromatische Verfahren
Außerdem gibt es verschiedene sogenannte säulenchromatografische Verfahren. Dabei wird das Proteingemisch über eine Säule, die ein Gel enthält, gegeben. Je nach Material und Bedingungen können die Proteine der Größe nach aufgetrennt werden. Auch eine Auftrennung durch die unterschiedliche Gesamtladung verschiedener Proteine ist möglich.
Am beliebtesten sind aber kleine Aminosäure-Anhängsel, sogenannte Tags, die den Proteinen angefügt werden. Die Information für die Tags ist bereits im Plasmid hinterlegt, wodurch sie automatisch bei der Produktion der Proteine an einem der beiden Enden der Aminosäurekette angehängt werden. Durch die speziellen Eigenschaften der Aminosäuren des Tags bindet das Protein reversibel an eine Gelmatrix, während alle anderen Proteine weggewaschen werden können.
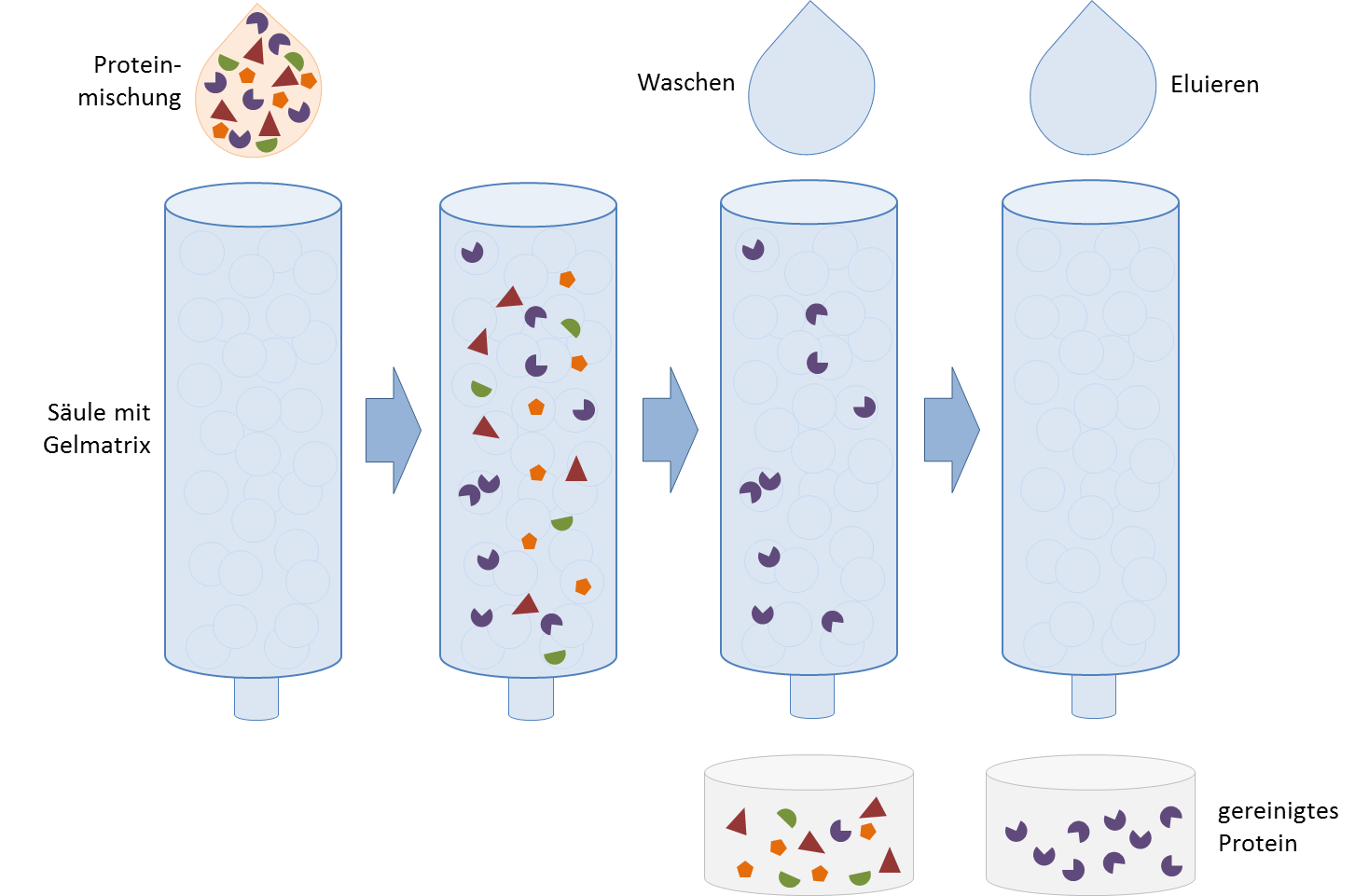
Abb.: Säulenchromatografie zur Reinigung von Proteinen mittels Tags